par Prof. Dr. Paul Berth
Voici quelques réflexions sur la théorie de l’acidification des océans. Selon cette théorie, le pH des océans diminuerait inlassablement, en raison du CO2 qui ne cesse de s’accumuler dans l’atmosphère.
• Les mesures directes de pH sont récentes et nous n’avons aucun recul. Selon les médias et les ONG écologistes, qui se basent sur le GIEC et sur certaines publications (e.g., Caldeira & Wickett 2003), le pH des océans aurait été de 8.25 en 1750. Cependant, il faut savoir que personne n’a jamais mesuré le pH des océans en 1750, puisque le concept de pH n’a été inventé qu’en 1909 (par le danois Søren P.L. Sørensen), et que les premiers appareils fiables pour mesurer le pH ne sont apparus qu’en 1924… Nous ne sommes donc pas certains de cette valeur de 8.25 pour 1750… La valeur de 8.25 est donc obtenue par des mesures indirectes et n’est donc pas certaine.
• A l’heure d’aujourd’hui, tous les pH sont possibles. Lorsqu’on dit que les océans actuels sont à un pH de 8.1, de quel océan parle-t-on? S’agit-il du pH moyen global? Si c’est de cela qu’on parle, quelle est l’incertitude sur la mesure? (i.e., l’écart-type?). Ceci n’est jamais indiqué. Il faut savoir que si l’on prend un jour de la semaine, tous les pH sont possibles dans les océans, comme l’illustre très bien la figure suivante.
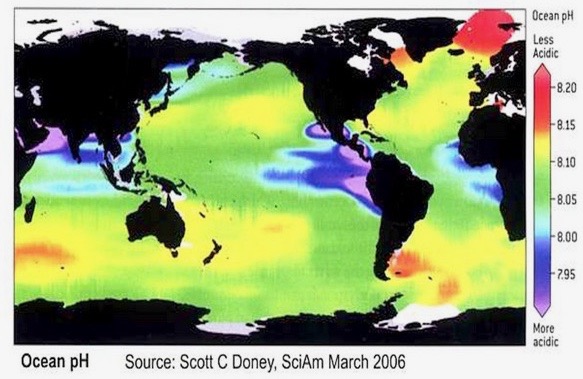
Nous voyons par exemple que nous avons des zones à pH 7.8, d’autres à 8.1 et encore d’autres à 8.2 voire plus. De nombreux organismes marins vivent déjà dans des zones ou le pH de l’eau de mer est plus acide ou plus basique que pH 8.1. Pas besoin d’attendre l’an 2100!
• Le pH varie grandement avec la température. Donner un pH moyen pour la Terre entière n’a aucun sens, vu que les masses océaniques changent constamment de température. Par exemple, prenons de l’eau de mer à 35‰ de salinité, avec une alcalinité totale de 2300 micromoles/kg, et 2000 micromoles/kg de carbone inorganique dissous (DIC). A 25°C le pH est de 8.05, à 20°C il est de 8.13 et à 15°C il est de 8.21. Cela veut dire qu’entre l’été et l’automne, le pH d’un endroit donné peut varier de 0.16 unités…
• Le pH moyen actuel est inconnu. Contrairement à la température moyenne globale, déterminée par deux réseaux de satellites, ainsi que deux séries thermométriques terrestres remontant à 1880, aucune série temporelle de longue durée n’existe pour le pH de l’eau de mer. Ceci est expliqué par la difficulté de mesurer le pH de manière automatique avec une grande précision. Il n’est pas non plus possible de mesurer le pH par satellite. Les quelques séries de mesure de pH disponibles pour l’eau de mer ne concernent que quelques endroits dans le monde. Il est donc impossible de connaître quel serait le pH moyen des océans actuels, encore moins celui du passé.
• Le pH de l’eau de mer diminue avec la profondeur. Un pH de 7.8 est déjà atteint vers 100 mètres de profondeur, voire moins. De nombreux organismes vivent dans cette zone et n’en sont pas affectés (voir figure ci-dessous).
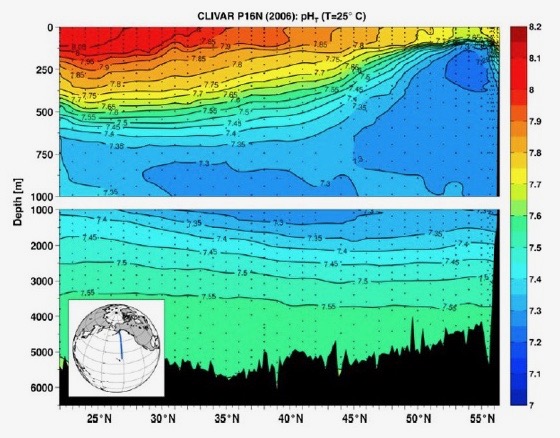
Transect de pH dans l’Océan Pacifique Nord, entre 25°N et 55°C, depuis la surface jusqu’à 6000 m de profondeur (Byrne et al. 2010) .
Les courants de remontée d’eau profonde (les « upwellings »), dépendant des vents, vont donc ramener de l’eau acide vers la surface, en modifiant localement le pH de l’eau de mer; l’upwelling va aussi provoquer de nombreuses modifications dans la structure des communautés phyto- et zooplanctoniques, car ces courants d’upwelling sont riches en nutriments. Un bel exemple est la zone d’upwelling située face aux côtes de l’Equateur en Amérique du Sud.
• Le pH de l’eau de mer varie énormément. Si l’on suit le pH de l’eau de mer à un endroit précis pendant 30 jours on peut se rendre compte des grandes variations de pH au niveau local. Ceci a été démontré par l’équipe de Hofmann en 2011 . Les variations mensuelles de pH de l’eau de mer dépassent très souvent 0.1 unité de pH. Le pH des zones côtières, c’est-à-dire les zones comportant la plus grande biodiversité marine, voient parfois leur pH varier de 0.5 à 1.0 unités en seulement quelques jours. Ceci n’affecte pas les organismes qui sont tous très bien adaptés aux variations naturelles du pH. Le pH des zones centrales des océans est par contre beaucoup plus stable.
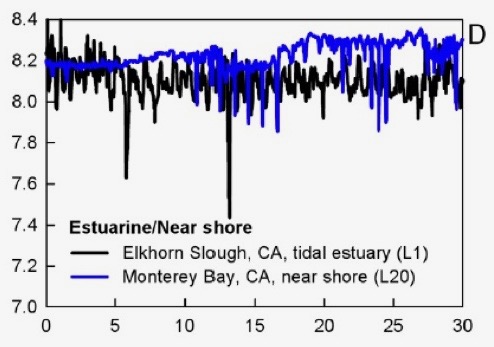
Variation naturelle du pH dans deux zones côtières (Hofmann et al. 2011). L’axe des x représente des jours. Les variations sont ici de 0.5 à 1.0 unités!
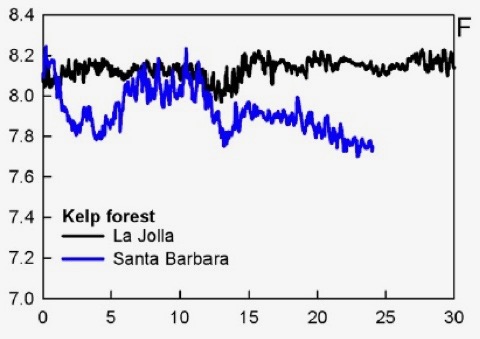
Variation naturelle du pH dans deux zones de forêts de kelp (Hofmann et al. 2011). L’axe des x représente des jours.
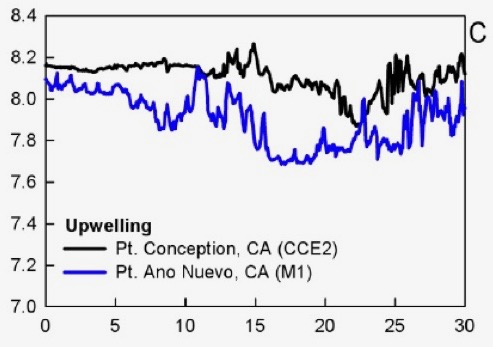
Variation naturelle du pH dans deux zones d’upwelling (Hofmann et al. 2011). L’axe des x représente des jours. Les variations sont ici de 0.3 à 0.4 unités.
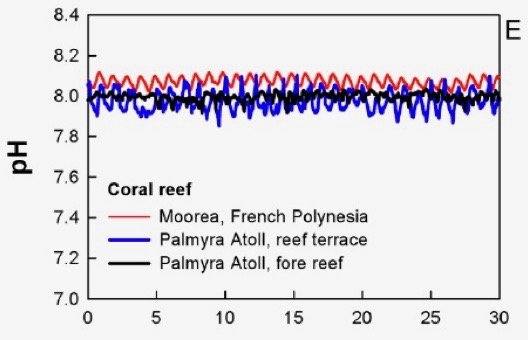
Variation naturelle du pH dans deux récifs coralliens (Hofmann et al. 2011). L’axe des x représente des jours. Le pH varie ici de 0.1 à 0.2 unités.
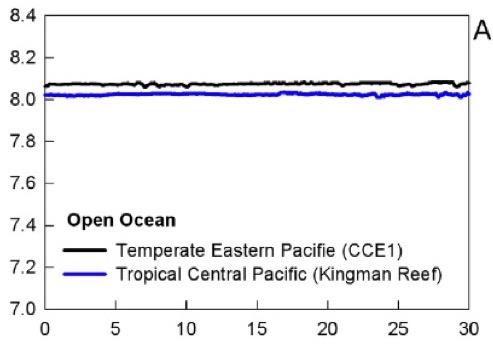
Variation naturelle du pH au centre de l’Océan Pacifique (Hofmann et al. 2011). L’axe des x représente des jours. Le pH ne varie ici que de 0.025 unités.
• Les organismes du phytoplancton et du zooplancton, mais aussi du bactérioplancton, ont tous une grande influence sur la pCO2 (pression partielle en CO2), l’alcalinité et le pH de l’eau de mer. Par exemple, la photosynthèse effectuée par le phytoplancton consomme du CO2 (aq) ce qui tend à provoquer une augmentation du pH; la respiration de la matière organique par les bactéries et par le zooplancton génère du CO2 (aq) ce qui tend à provoquer une diminution du pH; la fabrication de coquilles carbonatées (par exemple par les coccolithophoridés) consomme du CO32– alors que la dissolution en génère, ce qui tend aussi à faire varier le pH de l’eau de mer. La prolifération de tous ces organismes dépend de la présence de nutriments, de la température, de l’ensoleillement, mais aussi de la présence de prédateurs et de virus. L’eau de mer est loin d’être de l’eau pure et tous les organismes influencent le pH.
• Le biotope change constamment et les organismes s’adaptent constamment au biotope. Ceci avait déjà été constaté par Lamarck et bien entendu Darwin qui en parle longuement dans son célèbre livre publié en 1859. Les organismes évoluent sans cesse et les mieux adaptés au biotope survivent, les autres disparaissent. Dire que le pH de l’eau de mer devrait être stable, ainsi que le climat, est simplement nier toute l’évolution biologique qui ne peut se faire que dans un milieu qui varie au cours du temps. Toutes les populations animales sont capables de s’adapter aux petites variations de pH, de température ou de concentration en CO2 que nous connaissons actuellement. Aucun vrai biologiste ne peut penser sérieusement que 0.1 ou 0.5 unités de pH de plus ou de moins dans 100 ans serait un problème, sauf les « biologistes » qui nient la théorie de l’évolution. Les populations animales peuvent s’adapter, par exemple leur aire de répartition variera, et de toute façons les individus les moins adaptés seront éliminés.
• Modèles informatiques hasardeux. Ce sont des modèles informatiques qui prédisent le pH en 2100. Cependant, les prévisions sur le futur de notre planète sont pour le moins hasardeuses car de très nombreux paramètres influencent le pH. Comme le souligne le physicien Jacques Duran : « nous avons affaire à un énorme système d’équations différentielles à coefficients inconnus, non linéaires et couplées entre elles. Ces systèmes d’équations sont donc très difficiles à résoudre. En plus, certaines de ces équations se comportent de manière chaotique, c’est-à-dire qu’elles sont très sensibles aux conditions initiales souvent inconnues. Il n’y a pas pire. Pourtant, les programmeurs sur ordinateurs s’en donnent à coeur joie avec des milliers de paramètres inconnus et la forme des équations maîtresses qu’il faut essayer de deviner. Disons gentiment que, comme toujours, ils obtiennent des résultats mais le problème c’est que l’on peut faire évoluer les résultats comme on le désire en changeant un seul des paramètres ou une seule des équations inconnues. La croyance dans la véracité de telle ou telle prédiction d’ordinateur relève plus de la foi que de la certitude scientifique. Etant donné la multiplicité des méthodes de résolution possibles, les équations hasardeuses et le nombre de paramètres injectables, les résultats des simulations sur ordinateur sont très difficilement contrôlables par quiconque ne les a pas programmées lui-même. Bref, on nage dans le flou et les partis-pris prennent le dessus. Pour leur part, les politiques et les écologistes choisissent les résultats qui leurs conviennent, mais ils ignorent tout des nombreuses incertitudes, des approximations et des problèmes que posent les méthodes qui ont été employées. »
Références
Byrne RH et. al. 2010. Direct observations of basin-wide acidification of the North Pacific Ocean. Geophys Res Lett 37, L02601.
Caldeira, K. & Wickett, M. E. Anthropogenic carbon and ocean pH. Nature 425, 365 (2003).
Duran Jacques. http://www.pensee-unique.fr/theses.html.
Hofmann GE, Smith JE, Johnson KS, Send U, Levin LA, et al. (2011) High-Frequency Dynamics of Ocean pH: A Multi-Ecosystem Comparison. PLoS ONE 6(12): e28983. doi:10.1371/journal.pone.0028983.
Excellent commentaire qui démystifie la question.
Effectivement cet article est excellent : à vouloir tout simplifier/tout ignorer, on raconte/propage n’importe quoi. Finalement, trop de ‘choses’ sont basées sur pas grand ‘chose’. Les amateurs de raccourcis sont hélas légion…
Bonjour,
N’y a t-il pas une erreur ? Lorsque la température diminue, les océans sont plus acides et donc le pH diminue ?
Bien à vous !
Bonjour,
Lorsque la température de l’eau augmente, l’agitation des molécules d’eau (H2O) augmente, et plus de molécules d’eau se dissocient en H+ et en OH–. Si l’on prend comme définition pH = –log[H+], pour un certain volume d’eau donné, il y aura donc plus de H+ en solution. Le pH sera donc un peu plus bas lorsque la température augmente. Mais attention, car la proportion de H+/OH– ne variera pas. Le pH sera plus bas, mais l’eau ne sera pas plus acide…
Vous pouvez le vérifier vous-même avec l’application CO2calc :
https://soundwaves.usgs.gov/2011/03/research4.html
Vous pouvez aussi consulter cette page.
En conclusion, donner un pH sans spécifier la température de l’eau n’a aucun sens. Et donner un pH moyen qui s’appliquerait à de nombreuses températures océaniques différentes non plus.
A quelle bonne leçon d’impertinence vous nous conviez ici, Prof. Berth !
Haro sur ce conformisme de pensée qui nous entraîne vers l’hystérie collective à laquelle contribuent si efficacement divers sites (d’une présumée vulgarisation, des gazettes grand public, sans oublier de nombreux activistes dits « d’écosystèmes »).
Or que dans le même temps d’attrayants documentaires nous rappellent cette étrange biodiversité de la vie marine! Pire peut-être, chez ces chercheurs réduisant leur champ d’expérience dans le temps et la localisation des constats qu’ils en publient! Ceci me rappelle certains « faits monégasques » qui induisent autant à confusion… là où leurs sources de subsides s’étend tandis que s’accroît l’emprise immobilière sur la toute proche Méditerranée. Paradoxal…
A propos du « Couplage thermodynamique océan-atmosphère ». Le thème est abordé et très bien illustré dans un « Cours Hydrologie Marine – Courants, dont les effets de Coriolis », par le géographe Paul Durand 2007-08 Chap. 3. »
http://www.pantheonsorbonne.fr/IMG/pdf/Microsoft_PowerPoint_-_CM_4_et_5_eau_de_mer_et_CM_sans_GS.pdf
Il s’y trouve mention de la circulation thermohaline, documentée d’un cycle estimé de 500 à 1000 ans (avec cet upwelling, d’eaux de fond convergeant vers la surface). Ceci amenait Paul Durand à formuler des conclusions hypothétiques, de long terme susceptibles d’affecter notamment le courant du Gulfstream.
Curieusement, la thèse resurgit -médiatiquement- en 2018-19, figurant ici le phénomène tel un prochain risque millénariste (implicitement lié au RCA, « A » pour anthropique… naturellement). Ses auteurs omettaient toutefois d’y mentionner que la conséquence serait un refroidissement de l’Europe occidentale ! Chose d’un bilan incalculable par des modèles spéculatifs dont vous dénoncez la conception…
Bonjour, mes cours de chimie sont un peu loin, et j’ai un peu de mal à comprendre le concept de pH bas qui n’augmente pas l’acidité. Pouvez-vous étayer svp? Merci.
Mais donc si le pH est bas et si l’acidité des océans n’augmente pas dans ce cas, la question de l’acidification des océans ne se pose plus. Juste?
Sinon, sur wikipedia (https://fr.wikipedia.org/wiki/Potentiel_hydrog%C3%A8ne) , je note la chose suivante: l’eau de mer serait une « solution tampon ».
Un acide diminuera le pH d’une solution neutre ou basique ; une base augmentera le pH d’une solution acide ou neutre. Lorsque le pH d’une solution est peu sensible aux acides et aux bases, on dit qu’il s’agit d’une solution tampon (de pH) ; c’est le cas du sang, du lait ou de l’eau de mer, qui renferment des couples acido-basiques susceptibles d’amortir les fluctuations du pH, tels anhydride carbonique / hydrogénocarbonate / carbonate, acide phosphorique / hydrogénophosphate / phosphate, acide borique / borate.
Donc à partir de là, comment peut-on parler de changement et d’acidification des océans si celle-ci est une solution tampon?
J’imagine que c’est peut-être un peu plus compliqué que cela.
Bonjour,
Merci pour votre commentaire. L’article ne parle en effet pas du pouvoir tampon de l’eau de mer. Mais il est bien la! Certaines molécules naturellement présentes dans l’eau de mer « freinent » la montée ou la descente du pH lorsqu’on y ajoute ou retire des H+ Par exemple, lorsque du CO2 se dissout dans de l’eau de mer des H+ supplémentaires apparaissent (car CO2+H2O = H2CO3 = H+ + HCO3-). Les molécules tampon de l’eau de mer vont alors capter ces H+ supplémentaires et le pH ne changera pratiquement pas (car le pH est calculé avec les H+ libres, non fixés aux molécules tampon). Mais attention, une fois que toutes les molécules tampon auront capté des H+ elles ne savent plus en fixer d’autres. Le pouvoir tampon n’existe alors plus et le pH baissera si l’on continue d’ajouter du CO2 dans l’eau de mer. Le pouvoir tampon de l’eau de mer a donc des limites. Ce pouvoir tampon est également très variable d’un endroit à l’autre de la planète et d’un moment à l’autre de la journée car il est influencé par toutes les molécules organiques pouvant être présentes dans l’eau de mer.
D’accord c’est un peu comme la pomme de terre et sa capacité à absorber l’huile.
Mais ma question sur le pH reste entière. Pour moi, une baisse de pH entraine ou du moins signifie une acidification. En quoi donc un pH bas ou qui baisse n’augmente pas l’acidité?
S’il y a baisse de pH, c’est qu’il y a plus de H+ libres en solution, et donc cela signifie qu’il y a acidification. Mais attention, si le pH baisse de 8.9 à 8.2, on va dire qu’il y a acidification bien que l’on soit dans le domaine basique (au-dessus de pH 7.0).
OK merci, c’est plus clair. Effectivement, on joue sur la nuance.